A história do sabão e sua representação na química
A história de origem do sabão e sua representação na química.
Colégio Estadual Professor Edilson Souto Freire
Sala: 2°DM
professor: Catarina
Resumo:
Este artigo tem a intenção de mostrar, por meio da química, o processo histórico do sabão, desde o momento em que o homem aprendeu a manusear o fogo.
palavras-chave: Sabão, Química, História, Reações químicas
O aparecimento do sabão se deu em data incerta, já que as informações sobre o fato são tão variáveis que abrangem um período que se estende por quase dois milênios, a partir de 2.500 antes de Cristo. Uma das versões a respeito dessa descoberta diz que cerca de 600 anos antes de Cristo os antigos fenícios ferveram gordura de cabra com água e cinzas de madeira, produzindo dessa forma uma mistura pastosa com a qual limpavam o corpo.
Segundo esse relato, o produto sólido só foi criado no século 7, quando os árabes inventaram o chamado processo de saponificação, que em linhas gerais significa a transformação das substâncias gordas nesse tipo de produto solúvel em água. Mais adiante os espanhóis adicionaram o azeite de oliva para perfumá-lo, mas até então, na Europa, ele só, era conhecido pela nobreza de poucos países.
De acordo com uma antiga lenda romana a palavra saponificação tem sua origem no Monte Sapo, onde realizavam sacrifícios de animais. A chuva levava uma mistura de sebo animal (gordura) derretido, com cinzas e barro para as margens do Rio Tibre. Essa mistura resultava numa borra (sabão).
As mulheres descobriram que usando esta borra, suas roupas ficavam muito mais limpas. A essa mistura os romanos deram o nome de Sabão e à reação de obtenção do sabão de Reação de Saponificação. A primeira patente do processo de fabricação de sabão data de 1791.
Os sabões são feitos pela saponificação de gorduras e óleos. Qualquer reação de um éster com uma base, para produzir um álcool e o sal do ácido, é chamada uma reação de saponificação
Exemplo de reação de saponificação:
CH2OCOC17H35 CH2OH
│ │
CH2OCOC17H35 + 3 NaOH → CH2OH + 3C17H35COONa
│ │
CH2OCOC17H35 CH2OH
glicerídeo soda glicerol sabão
cáustica
│ │
CH2OCOC17H35 + 3 NaOH → CH2OH + 3C17H35COONa
│ │
CH2OCOC17H35 CH2OH
glicerídeo soda glicerol sabão
cáustica

Sabão: mistura de um éster com uma base.
A equação abaixo demonstra este processo:
Éster + base forte → sabão + glicerol
Praticamente todos os ésteres são retirados de óleos e gorduras, daí o porquê das donas de casa usarem o óleo comestível para o feitio do sabão caseiro.
Equação genérica da hidrólise alcalina:
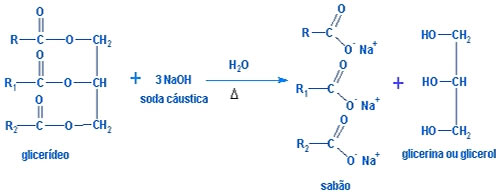
A equação acima representa a hidrólise alcalina de um óleo (glicerídeo). Dizemos que é uma hidrólise em razão da presença de água (H2O) e que é alcalina pela presença da base NaOH (soda cáustica). O símbolo ∆ indica que houve aquecimento durante o processo. Produtos da reação de Saponificação: sabão e glicerol (álcool).
Soda Cáustica e Sabão
É comum um sabão ter o pH muito alcalino. Esta circunstância provoca o efeito danoso da abertura da escamas da cutícula formada por queratina. Como termo de comparação, esta propriedade é utilizada nos tingimentos (cores escuras) capilares visto que é necessário que o pigmento penetre na medula do fio.
A soda cáustica ou hidróxido de sódio (NaOH – PM = 40), é um sólido esbranquiçado, deliqüescente, pode se apresentar na forma sólida (em barra, escamas, pérolas, flocos, grânulos, lentilhas, pó, massa fundida, pastilhas ou cilindros brancos secos, duros, quebradiços, de fratura cristalina, inodoros e de sabor ardente) ou na forma líquida em concentração de até 73%.
Apresenta grande solubilidade em água (1:1) e álcool. O pH da solução tem a seguinte equivalência: pH = 11 (solução à 0,01% em água), pH = 12 (solução à 0,05% em água), pH = 13 (solução à 0,5% em água), pH = 14 (solução à 5% em água) (TRIKEM, 2002 & FARMACOPÉIA BRASILEIRA, 1977).
A Soda Cáustica é utilizada na fabricação de celulose, alumínio, sabões e detergentes, fibra sintética rayon, celofane, sais de sódio em geral, corantes e pigmentos, vidros, produtos farmacêuticos, cosméticos, na produção de Hipoclorito de Sódio e de outros produtos para tratamento de água.
| Diferenças entre sabão e Detergente | ||
| Parâmetro | Sabão | Detergente |
| Matéria prima | Óleo e gordura | Petróleo |
| Comportamento no ambiente | Biodegradável | Biodegradável ou não |
| Solubilidade em água | Pouco solúvel | Muito solúvel |
| Capacidade de limpeza | Fraca | Alta |
| Água dura | Não pode ser usado | Pode ser usado |
| Acidez | Não pode ser usado em meio ácido | Pode ser usado em meio ácido |
A partir do século XIII o sabão passou a ser produzido em quantidades suficientes para ser considerado uma indústria.
Até o princípio do século XIX, pensava-se que o sabão fosse uma mistura mecânica de gordura e álcali; um químico francês,Chevreul, mostrou que a formação do sabão era na realidade uma reação química.Nesta época,Domeier completou estas pesquisas, recuperando a glicerina das misturas da saponificação.
Matérias-Primas empregadas na fabricação de sabões:
1) essenciais
2) secundárias
3) coadjuvantes.
Matérias-primas essenciais – São as matérias indispensaveis para obtenção do sabão, sem as quais não ocorreria a saponificação.Estas são as matérias graxas e matérias alcalinas.
Matérias-primas secundárias – São aquelas sem as quais a saponificação pode ocorrer, mas que são adicionadas ao produto a fim de melhorar a sua qualidade ou baixar seu preço de custo.
Sao três espécies: resinas, matérias de recheio, corantes e perfumes.
Matéras-primas coadjuvantes – São as que não entram, propriamente, na composição do sabão, mas são empregadas, tão somente, como veículo ou meio do processo de fabricação.As principais são a água e o cloreto de sódio.
A história do sabão e do sabonete ao longo dos tempos
No ano 600 a.C. os Fenícios usavam terra argilosa contendo calcário ou cinzas de madeira (sabão pastoso).
No séc. I d.C. Gaius Plinius Secundus (23 ou 24-79 d.C.), autor da História Natural, menciona a preparação do sabão a partir do cozimento do sebo de carneiro com cinzas de madeira. O procedimento envolve o tratamento repetido da pasta resultante com sal, até ao produto final.
Segundo Plínio, os Fenícios conheciam a técnica desde 600 a.C.
No séc. II d.C. , o médico grego Galeno (130-200 d. C) descreve uma técnica segundo a qual o sabão podia ser preparado com gorduras e cinzas, mostrando a sua utilidade para a remoção de sujidade corporal e de tecidos mortos da pele.
No séc. IV, o sabão é usado em Roma apenas para lavar os cabelos.
No séc. VIII o alquimista árabe Geber menciona o sabão como agente de limpeza.
No séc. XIII é criado o sabão sólido, quando os árabes descobrem o processo de saponificação (mistura de óleos naturais, gordura animal e soda cáustica que depois de fervida endurece).
Nos séculos XV e XVI várias cidades europeias tornam-se centros produtores de sabão, na época um produto de luxo, usado apenas por pessoas ricas.
No séc. XVIII é registada a primeira patente do processo de fabricação de sabão; o químico francês Nicolas Leblanc consegue obter soda caústica a partir do sal de cozinha e, pouco depois, cria-se o processo de saponificação das gorduras, dando um grande avanço na fabricação de sabão.
No séc. XIX o químico James Gamble descobre como produzir sabão branco, cremoso e perfumado. O seu primo Harley Procter (dono de uma fábrica de velas e sabão) passa a promover esse sabonete, prevendo que com a eletricidade, o seu negócio de velas poderá acabar. Durante este século surgiu também o Sabonete “Roger & Gallet” o primeiro sabonete redondo, envolto artesanalmente em papel drapeado.
O sabão e o sabonete à lupa
O sabão praticamente neutro, que contém glicerina, óleos, perfumes e corantes, é o sabonete.
O sabão permite remover certos tipos de sujidade que a água, sendo polar, não consegue remover, como restos de óleo, apolares. O sabão exerce um papel importantíssimo na limpeza porque possui uma cadeia apolar, capaz de interagir com o óleo e uma extremidade polar, capaz de interagir com a água, conforme representado na figura abaixo.

A glicerina é um subproduto da fabricação do sabão, também vendido nas fábricas de sabão. Este sub-produto é adicionado aos cremes de beleza e sabonetes (permite manter a humidade da pele) ou a produtos alimentícios (mantém a humidade do produto).

Glicerina
Ao tentarmos misturar a gordura/azeite com a água, temos apenas isso mesmo uma tentativa porque o fenómeno não se dá. O azeite e a água não se misturam devido á sua estrutura química, são completamente incompatíveis, assim por mais que tentemos a água e a gordura nunca se irão misturar. É por isso que quando colocamos a gordura dentro de água ela permanece á superfície, formando uma película.
conclusão
Referências
Propaganda
Acabaram seus problemas para tirar manchas dona de casa.
Chegou o novo sabão da vovó química, feito com produtos reaproveitados, e não tira só mancha das roupas em, tira também de chão, paredes, lava até Madeira.
A melhor parte é q só custa 1,99$ é isso mesmo apenas 1,99$.
O melhor sabão por um preço q cabe no seu bolso.
Link do documentário
https://youtu.be/ZGugICT3Hao
Link do documentário
https://youtu.be/ZGugICT3Hao
Comentários
Postar um comentário